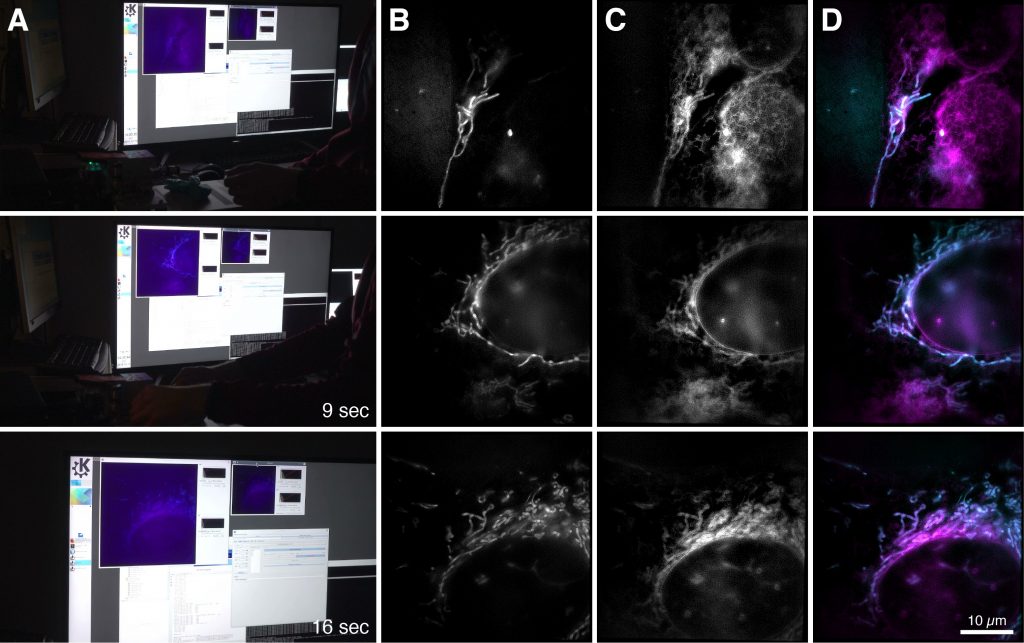
Aufnahmen des neuen Mikroskops: Ganz links das auf dem Computer dargestellte Bild, rechts die Mikroskopbilder. Man sieht dort eine Knochenkrebszelle mit Mitochondrien (blau) und endoplasmatischem Retikulum (rosa). Die unterschiedlichen Reihen zeigen Aufnahmen zu unterschiedlichen Zeiten. Foto: Universität Bielefeld/W. Hübner 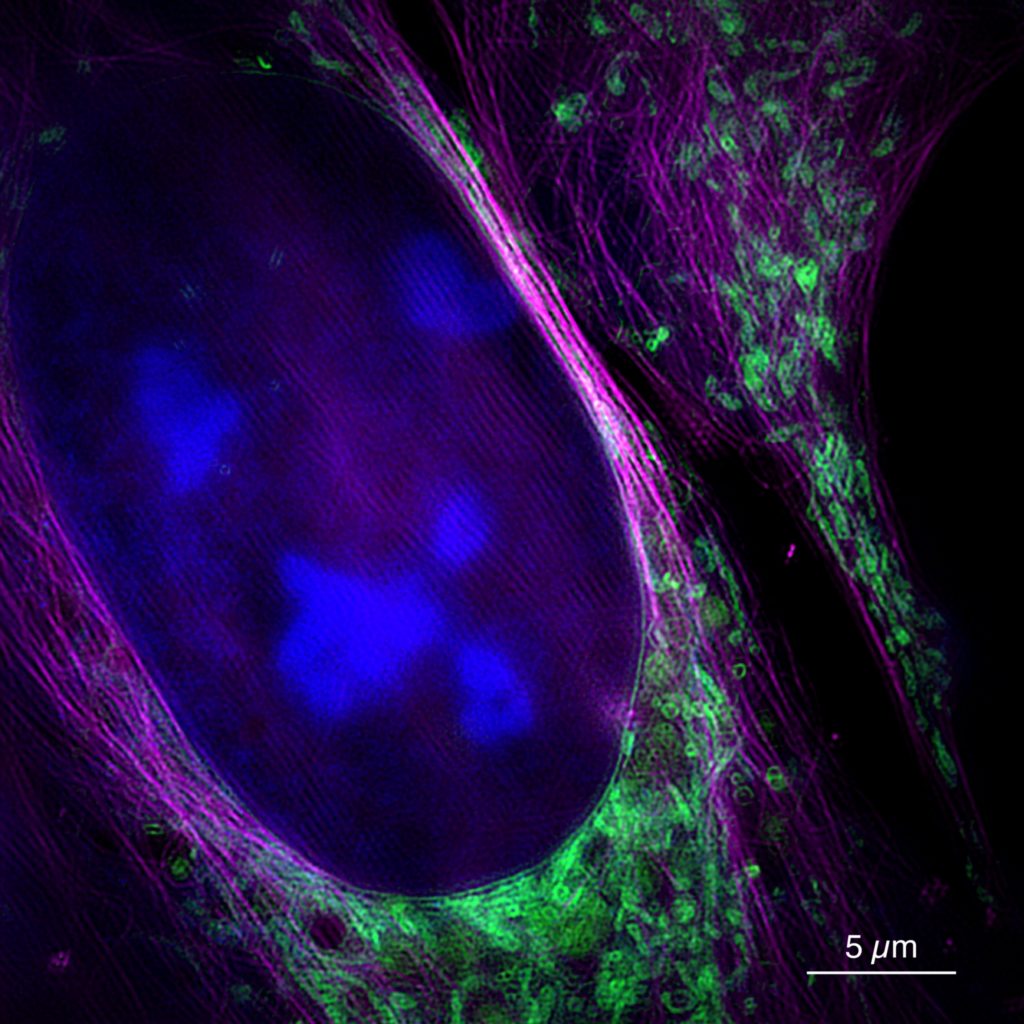
Diese Aufnahme des neuen Mikroskops zeigt eine lebende Knochenkrebszelle mit Zellkern (blau), Mitochondrien (grün) und Zytoskelett (magenta). Foto: Universität Bielefeld/W. Hübner

Der Physiker Prof. Dr. Thomas Huser leitet die Arbeitsgruppe Biomolekulare Physik an der Universität Bielefeld. Foto: Universität Bielefeld 
Andreas Markwirth von der Arbeitsgruppe Biomolekulare Physik ist Erstautor der Studie. Foto: Universität Bielefeld/A. Markwirth

Physicist Professor Dr Thomas Huser heads the Biomolecular Physics Working Group at Bielefeld University. Photo: Bielefeld University 
Physicist Andreas Markwirth of the Biomolecular Physics Working Group is the lead author of the study. Photo: Bielefeld University/A. Markwirth
Sie können winzig kleine Zellstrukturen sichtbar machen: Modernste Lichtmikroskope bieten Auflösungen von wenigen zehn Nanometern – also dem Millionstel eines Millimeters. Bisher waren superauflösende Mikroskopien allerdings deutlich langsamer als herkömmliche Verfahren, da mehr oder feinere Bilddaten aufgenommen werden mussten. Forschende der Universität Bielefeld haben nun gemeinsam mit Partnern aus Jena das superauflösende Verfahren SR-SIM weiterentwickelt. Die Wissenschaftlerinnen und Wissenschaftler zeigen, dass SR-SIM auch in Echtzeit sowie mit einer sehr hohen Bildfrequenz möglich ist – und damit geeignet, um zum Beispiel Bewegungen von sehr kleinen Zellpartikeln zu beobachten. Ihre Ergebnisse wurden heute (20. September) im Fachmagazin „Nature Communications“ veröffentlicht.
„Erst dadurch wird diese Art von Mikroskopie für die Anwendung in der Biologie oder Medizin auch wirklich nützlich. Denn das Problem ist bisher: Mikroskope, die eine ausreichend hohe Auflösung bieten, können Informationen nicht in der entsprechenden Geschwindigkeit darstellen“, sagt Professor Dr. Thomas Huser, der die Arbeitsgruppe Biomolekulare Physik an der Universität Bielefeld leitet. Das Projekt zu SR-SIM wird von der Deutschen Forschungsgemeinschaft sowie der Europäischen Union über Marie-Skłodowska-Curie-Maßnahmen gefördert.
SR-SIM steht für „super-resolved structured illumination microscopy“ und ist ein fluoreszenzmikroskopisches Verfahren. Hierbei werden Objekte mit Laser-Licht bestrahlt. Dieses Licht regt besondere, fluoreszierende Moleküle in der Probe an, sodass sie Licht in einer anderen Wellenlänge wieder abstrahlen. Die mikroskopische Aufnahme zeigt dann das abgestrahlte Licht. „Im Unterschied zu herkömmlichen fluoreszenzmikroskopischen Verfahren werden die Präparate bei SR-SIM jedoch nicht gleichmäßig, sondern über ein feines, gitterförmiges Muster beleuchtet. Diese spezielle Technik ermöglicht die viel höhere Auflösung“, sagt Huser.
Das Verfahren verläuft in zwei Schritten: Das vom Präparat abgestrahlte Licht wird zunächst in mehreren Einzelbildern aufgenommen. Aus diesen Rohdaten wird im Anschluss das fertige Bild auf einem Computer rekonstruiert. „Vor allem der zweite Schritt hat bisher sehr viel Zeit gekostet“, sagt Andreas Markwirth, ebenfalls von der Arbeitsgruppe Biomolekulare Physik der Universität Bielefeld. Er ist Erstautor der Studie. Die Bielefelder Forschenden haben daher zusammen mit Professor Dr. Rainer Heintzmann vom Leibniz-Institut für Photonische Technologien sowie der Friedrich-Schiller-Universität in Jena daran gearbeitet, das Verfahren schneller zu machen. Das Mikroskop ist nun so ausgelegt, dass die Rohdaten schneller erzeugt werden. Zudem nimmt auch die Bildrekonstruktion dank des Einsatzes von Parallelrechner-Verfahren auf modernen Grafikkarten deutlich weniger Zeit in Anspruch.
Für ihre Studie haben die Wissenschaftlerinnen und Wissenschaftler das neue Verfahren an biologischen Zellen getestet und die Bewegungen von Mitochondrien aufgezeichnet, etwa einen Mikrometer kleinen Zellorganellen. „Wir konnten ungefähr 60 Einzelbilder pro Sekunde erzeugen – das ist eine höhere Bildfrequenz als bei Kinofilmen. Zwischen Messung und Bild liegen weniger als 250 Millisekunden, daher erlaubt die Technik Echtzeitaufnahmen“, sagt Markwirth.
Bisher werden superauflösende oft mit herkömmlichen Verfahren kombiniert: Ein herkömmliches schnelles Mikroskop wird genutzt, um Strukturen zunächst zu finden. Danach können diese Strukturen über ein superauflösendes Mikroskop im Detail untersucht werden. „Manche Strukturen sind aber so klein, dass sie mit herkömmlichen Mikroskopen gar nicht erst gefunden werden können, zum Beispiel spezielle Poren in Leberzellen. Unser Verfahren ist sowohl hochauflösend als auch schnell – das ermöglicht Biologinnen und Biologen, solche Strukturen zu erforschen“, sagt Huser. Eine andere Anwendung für das neue Mikroskop ist die Untersuchung von Virenpartikeln auf ihrem Weg durch die Zelle. „So können wir nachvollziehen, was bei Infektionsprozessen genau passiert“, sagt Huser. Er erwartet, dass das Mikroskop im Laufe des nächsten Jahres für solche Studien an der Universität Bielefeld zum Einsatz kommen kann.
Superauflösende Mikroskope gibt es erst seit etwa 20 Jahren. Der Physiker Ernst Abbe hatte 1873 herausgefunden, dass die Auflösung eines optischen Systems für sichtbares Licht auf etwa 250 Nanometer begrenzt ist. In den vergangenen Jahren wurden jedoch gleich mehrere optische Verfahren entwickelt, um die Abbe’sche Auflösungsgrenze zu unterschreiten. Für die Entwicklung einer Superauflösung im Bereich von etwa 20 bis 30 Nanometer erhielten die US-Amerikaner William E. Moerner und Eric Betzig sowie der Deutsche Stefan Hell 2014 den Nobelpreis für Chemie.
Originalveröffentlichung:
Andreas Markwirth, Mario Lachetta, Viola Mönkemöller, Rainer Heintzmann, Wolfgang Hübner, Thomas Huser, Marcel Müller: Video-Rate Multi-Color Structured Illumination Microscopy with Simultaneous Real-Time Reconstruction. Nature Communications, https://doi.org/10.1038/s41467-019-12165-x, erschienen am 20. September 2019.
University researchers improve super-resolution microscopy
They can make tiny cell structures visible: cutting-edge light microscopes offer resolutions of a few tens of nanometres—in other words, a millionth of a millimetre. Until now, super-resolution microscopes were much slower than conventional methods, because more or finer image data had to be recorded. Together with partners from Jena, researchers from Bielefeld University have now developed the super-resolution SR-SIM process further. The academics show that SR-SIM is also possible in real time and at a very high imaging rate—and thus suitable for observing movements of very small cell particles, for example. Their findings have been published today (20 September) in the journal “Nature Communications”.
“This is what makes this type of microscopy really useful for applications in biology or medicine. The problem so far is that microscopes offering a sufficiently high resolution cannot display information at the corresponding speed,” says Professor Dr Thomas Huser, who heads the Biomolecular Physics Working Group at Bielefeld University. The SR-SIM project is funded by the German Research Foundation (DFG) and the European Union through Marie Skłodowska-Curie Actions.
SR-SIM stands for “super-resolution structured illumination microscopy” and is a fluorescence microscopy procedure. Objects are irradiated with laser light. This light excites special fluorescent molecules in the sample so that they re-emit light at a different wavelength. The microscopic image then shows the re-emitted light. “Unlike other conventional fluorescence microscopy methods, SR-SIM does not illuminate the specimens uniformly, but with a fine, grid-like pattern. This special technology enables much higher resolution,” says Huser.
The procedure consists of two steps: the light re-emitted by the specimen is first recorded in several individual images. The finished image is then reconstructed on a computer from these raw data. “The second step, in particular, has cost a great deal of time so far,” says Andreas Markwirth, also a member of Bielefeld University’s Biomolecular Physics Working Group and lead author of the study. The Bielefeld researchers therefore worked together with Professor Dr Rainer Heintzmann from the Leibniz Institute for Photonic Technologies and the Friedrich Schiller University in Jena to speed up the process. The microscope is now designed to generate the raw data faster. In addition, image reconstruction takes considerably less time thanks to the use of parallel computer processing on modern graphics cards.
For their study, the researchers tested the new method on biological cells and recorded the movements of mitochondria, cell organelles about one micrometre in size. „We have been able to produce about 60 frames per second—a higher frame rate than cinema films. The time between measurement and image is less than 250 milliseconds, so the technology allows real-time recording,” says Markwirth.
Up to now, super-resolution methods have often been combined with conventional methods: a conventional fast microscope is used to first find structures. These structures can then be examined in detail using a super-resolution microscope. “However, some structures are so small that they cannot be found with conventional microscopes, for example specific pores in liver cells. Our method is both high-resolution and fast, which enables biologists to explore such structures,” says Huser. Another application for the new microscope is the study of viral particles on their way through the cell. “This enables us to understand exactly what happens during infection processes,” says Huser. He expects the microscope to be used for such studies at Bielefeld University during the coming year.
Super-resolution microscopes have only been around for about 20 years. In 1873, Ernst Abbe had discovered that the resolution of an optical system for visible light is limited to about 250 nanometres. In recent years, however, several optical methods have been developed to break what has become known as Abbe’s diffraction barrier. In 2014, William E. Moerner and Eric Betzig, both from the USA, as well as Stefan Hell from Germany were awarded the Nobel Prize in Chemistry for developing a super-resolution in the range of about 20 to 30 nanometres.
Original publication:
Andreas Markwirth, Mario Lachetta, Viola Mönkemöller, Rainer Heintzmann, Wolfgang Hübner, Thomas Huser, Marcel Müller: Video-Rate Multi-Color Structured Illumination Microscopy with Simultaneous Real-Time Reconstruction. Nature Communications, https://doi.org/10.1038/s41467-019-12165-x, published on 20 September 2019.




